LIBRO DE QUÍMICA RUBIÑOS 2024 DESCARGA GRATIS PDF
La química es una ciencia natural que mediante la experimentación intenta conocer y explicar las propiedades de la materia con el principal objetivo de encontrar sustancias que puedan satisfacer alguna necesidad del ser humano , tales como en la medicina ,en la agricultura , en la industria de polímeros , en la industria nuclear ,nanotecnología ,etc.
- Ver QUÍMICA PREGUNTAS RESUELTAS
- Ver EL MÉTODO CIENTÍFICO
- Ver MATERIA Y ENERGÍA
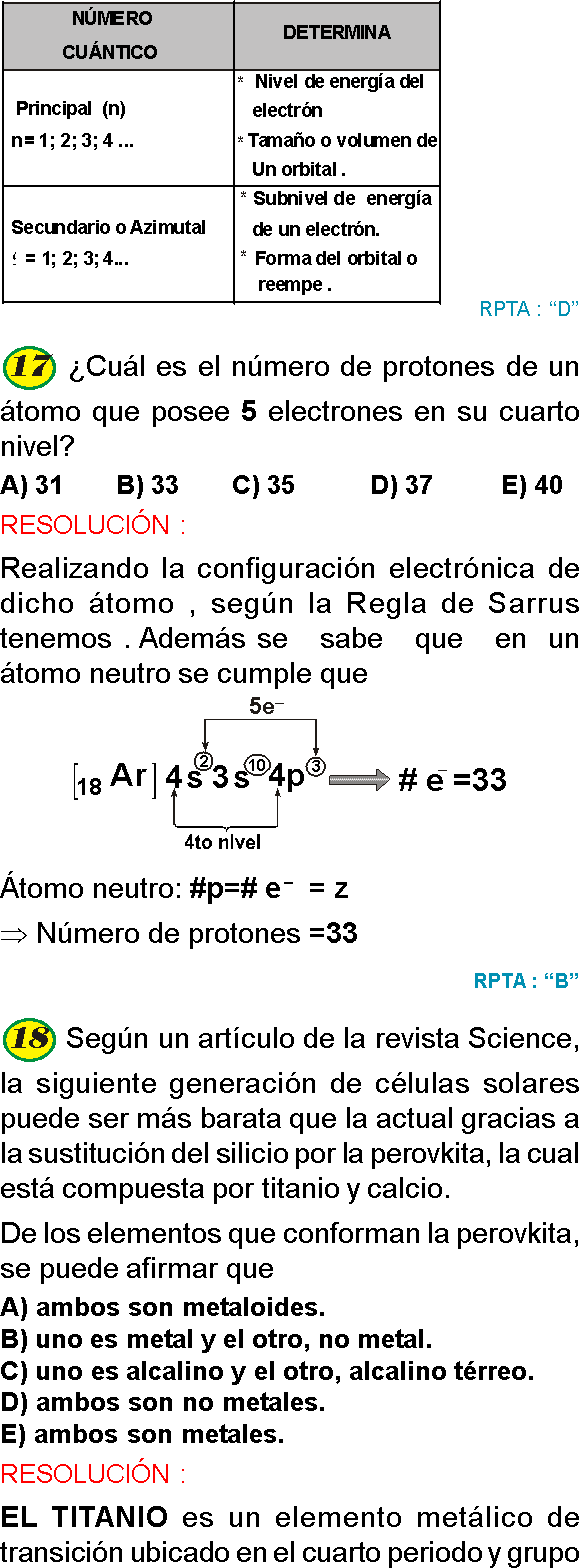
- Ver ESTRUCTURA ATÓMICA
- Ver QUÍMICA NUCLEAR
- Ver NÚMEROS CUÁNTICOS
- Ver CONFIGURACIÓN ELECTRÓNICA
- Ver TABLA PERIÓDICA
- Ver ENLACE QUÍMICO
- Ver NOMENCLATURA INORGÁNICA
- Ver UNIDADES QUÍMICAS DE MASA
- Ver COMPOSICIÓN CENTESIMAL FÓRMULA EMPÍRICA Y MOLECULAR
- Ver BALANCE DE ECUACIONES QUÍMICAS
- Ver REACCIONES QUÍMICAS
- Ver ESTEQUIOMETRÍA
- Ver ESTADO GASEOSO
- Ver SOLUCIONES QUÍMICAS
- Ver EQUILIBRIO QUÍMICO
- Ver ÁCIDOS Y BASES
- Ver ELECTROQUÍMICA
- Ver CONTAMINACIÓN AMBIENTAL
- Ver BIOTECNOLOGÍA
- Ver EXAMEN ADMISIÓN SAN MARCOS
- Ver EXAMEN ADMISIÓN VILLARREAL
- Ver EXAMEN CALLAO
- Ver EXAMEN PNP SUB-OFICIALES
- Ver EXAMEN UNI
- Ver REPASO UNI RESUELTO
- Ver SIMULACRO SAN MARCOS
- Ver SOLUCIONARIOS PRE SAN MARCOS
La Química toca casi todos los aspectos de nuestras vidas, nuestra cultura y nuestro entorno. Su ámbito comprende el aire que respiramos, los alimentos que comemos, los líquidos que bebemos, nuestro vestido, vivienda, transporte y suministro de combustible, y a nuestros semejantes.
Con la Química podemos contestar estas y muchas otras preguntas que nos hacemos siempre que observamos nuestro entorno.
Algunos historiadores de la ciencia creen que la palabra «química» deriva del vocablo griego khémeia, que significa «el arte del trabajo de los metales».
Obviamente, la Química moderna incluye mucho más que esto.
La Química ha llegado a ser una ciencia interdisciplinaria, y a la fecha ningún trabajo científico le es ajeno. Muchas de las modernas incógnitas en medicina y biología están siendo exploradas a nivel de átomos y moléculas, que son los bloques fundamentales de la materia en los que se basa el estudio de la Química. Muchos químicos están ahora dedicados al diseño y síntesis de fármacos para tratar una variedad de enfermedades y combatir el cáncer.
Además, muchos gobiernos y el público en general también están interesados en la conservación del ambiente y el hallazgo de nuevas fuentes de energía. Tales problemas sólo podrán ser resueltos mediante la aplicación ingeniosa de lo que se sabe acerca de las características químicas de los sistemas implicados. Y la mayoría de las industrias, cualesquiera que sean sus productos, dependen del trabajo de químicos.
Por ejemplo, a través de años de investigación los químicos han aprendido a elaborar polímeros (moléculas que contienen miles de átomos) de diversos tamaños y formas que se emplean en la fabricación de ropa, utensilios de cocina, juguetes y artículos domésticos.
Los químicos diseñan productos nuevos y mejores técnicas para manufacturar los ya conocidos.
Vigilan la composición de la materia prima que entra a las plantas manufactureras y verifican la calidad de los productos terminados.
PRACTICA TIPO ADMISIÓN
PREGUNTA 1 :
Los fenómenos químicos son aquellos en los cuales se altera la estructura interna de la materia, es decir, rompiendo y formando nuevos enlaces químicos, mientras que en los fenómenos físicos no ocurren dichos cambios. Para los siguientes fenómenos, determine el número de fenómenos físicos y químicos respectivamente:
• Licuación del propano
• Corrosión del hierro
• Fermentación de la glucosa
• Solidificación del agua
• Destilación del agua de potable
• Fotólisis del peróxido de hidrógeno
A) 3 y 3
B) 2 y 4
C) 1 y 5
D) 4 y 2
E) 5 y 1
Rpta. : "A"
PREGUNTA 2 :
El hierro o fierro elemento químico sólido, gris plateado resaltándose por el brillo metálico; pero expuesto al ambiente húmedo cambia de color y deja de brillar debido a la formación de óxidos FeO y Fe2O3. Al respecto indique la secuencia correcta de verdad (V) o falsedad (F).
I) Ambos óxidos son compuestos diatómicos
II) El hierro es una sustancia simple
III) La formación de óxidos son fenómenos químicos
A) FVV
B) FFV
C) VVV
D) VVF
E) VFV
Rpta. : "A"
PREGUNTA 3 :
El cromado de una fina capa de cromo (Z=24) sobre el acero inoxidable contiene isótopos Cr-52, Cr-53 y Cr-54, al respecto indique la secuencia correcta de verdad (V) o falsedad (F).
I) El isótopo pesado en la capa M contiene cinco electrones
II) El isótopo pesado posee seis electrones desapareados
III) Los isótopos poseen igual configuración electrónica
A) VVF
B) VFV
C) FVV
D) FFV
E) FVF
Rpta. : "C"
PREGUNTA 4 :
El último electrón en el átomo basal del gas noble Neón se representa por el siguiente juego de números cuánticos 2, 1, + 1, – 1/2, entonces indique las proposiciones incorrectas para dicho electrón.
I) Se encuentra en el nivel 2 o capa M.
II) Respecto a su eje de giro, el electrón rota en sentido antihorario.
III) Pertenece al orbital de geometría dilobular.
A) solo II
B) solo III
C) I y II
D) I y III
E) II y III
Rpta. : "C"
PREGUNTA 5 :
Con respecto a la variación general de las propiedades periódicas de los elementos químicos, en la tabla periódica moderna, indique la secuencia correcta de verdad (V) o falsedad (F).
I) En un periodo, el átomo de menor radio tiene mayor energía de ionización.
II) En un grupo, la electronegatividad de los átomos guarda relación directa con el número atómico.
III) Mayor afinidad electrónica corresponde a los no metales.
A) VVF
B) VFF
C) FFV
D) VFV
E) FVF
Rpta. : "D"
PREGUNTA 6 :
La tabla periódica moderna tiene los elementos ordenados en grupos y periodos. Con relación a esto, indique las proposiciones que son correctas.
I) Sus elementos están ordenados en función de sus números atómicos crecientes.
II) Tiene 18 periodos según la IUPAC.
III) En la columna 18 están los gases nobles.
A) solo I
B) solo II
C) solo III
D) I y III
E) I, II y III
Rpta. : "D"
PREGUNTA 7 :
El hidróxido de potasio KOH, es una base fuerte de uso común , tanto industriales como comerciales. Es el precursor de la mayoría de jabones suaves y líquidos. ¿Qué proposiciones son correctas respecto al compuesto citado?
Numero atómico: H=1; O=8; K=19
I) Es un compuesto iónico ternario.
II) Tiene dos enlaces simples.
III) Se disuelve en el agua.
A) II y III
B) I y II
C) Solo III
D) I y III
E) I, II y III
Rpta. : "D"
PREGUNTA 8 :
El cloruro de potasio se utiliza en medicina, aplicaciones científicas, procesamiento de alimentos y en ejecución legal por medio de inyección letal. Respecto a las propiedades generales del cloruro de potasio, KCℓ, ¿qué propiedades son correctas?
I) A 25°C es un sólido cristalino.
II) En medio acuoso no conduce la corriente eléctrica.
III) Posee alto punto de fusión y ebullición.
A) I y III
B) Solo III
C) II y III
D) Solo II
E) I, II y III
Rpta. : "A"
PREGUNTA 9 :
Un óxido básico es un compuesto iónico, que se forma cuando el oxígeno se combina con un metal; un óxido ácido, es un compuesto covalente que resulta cuando el oxígeno reacciona con un no metal. Seleccione la relación incorrecta entre el nombre y la fórmula de los siguientes óxidos.
A) óxido de azufre (IV): SO2
B) óxido sódico: Na2O
C) trióxido de dinitrogeno: N2O3
D) óxido cuproso: CuO
E) óxido niquélico: Ni2O3
Rpta. : "D"
PREGUNTA 10 :
Los hidrocarburos poseen solo carbono e hidrogeno cuyas fuentes principales de obtención son el petróleo y el gas natural. Se emplean principalmente como combustibles y en la producción de diversos materiales (plásticos, textiles, fármacos, aceites lubricantes). Para una molécula de 2-hepten-5-ino, CH3CHCHCH2CCCH3. Determine el número de electrones pi y enlaces sigma que tiene respectivamente.
A) 3 y 16
B) 3 y 32
C) 5 y 16
D) 4 y 32
E) 6 y 16
Rpta. : "E"
PREGUNTA 11 :
El NiSO4 es una sal cristalina de color verde y sin olor; es obtenida como subproducto del refinado de cobre y es empleado en procesos de niquelado. Con respecto al compuesto NiSO4, indique la alternativa que presenta la secuencia correcta luego de determinar si la proposición es verdadera (V) o falsa (F).
I) Es una sal oxisal ternaria.
II) El estado de oxidación del azufre es + 6.
III) Su nombre tradicional es sulfato niqueloso.
A) VVV
B) VFV
C) VFF
D) FVV
E) VVF
Rpta. : "A"
PREGUNTA 12 :
Los ácidos oxácidos son compuestos ternarios, en general, se obtienen por reacción química de un óxido ácido con el agua. Respecto a lo anterior, indique el nombre común o tradicional de los compuestos HBrO2, H2SO3 y H3PO4.
A) ácido bromoso, ácido sulfúrico y ácido fosfórico
B) ácido brómico, ácido sulfuroso y ácido fosfórico
C) ácido brómico, ácido sulfúrico y ácido fosforoso
D) ácido bromoso, ácido sulfuroso y ácido fosfórico
E) ácido bromoso, ácido sulfúrico y ácido fosforoso
Rpta. : "D"
PREGUNTA 13 :
El vinagre es una mezcla líquida, contiene agua H2O y ácido acético CH3COOH. En laboratorio de química se analiza la composición porcentual del ácido acético a partir de 200 mL de vinagre. Indique el resultado del carbono e hidrógeno respectivamente.
PA (uma): C=12, O=16, H=1
A) 40,00 % 53,33%
B) 53,33% 6,67%
C) 40,00% 13,34%
D) 40,00% 6,67%
E) 20,00% 5,00%
Rpta. : "D"
PREGUNTA 14 :
Para el proceso químico de neutralización, usando el hidróxido en estado sólido.
3Mg(OH)2+2H3PO4→ Mg3(PO4)2+6H2O
Al respecto determine de valor de verdad (V o F) de las siguientes proposiciones.
I) El de mayor de atomicidad es la sal producida
II) En 3 mol de hidróxido hay 3 mol de ion hidróxido
III) El peso fórmula del oxidano es 108 uma
Masa atómica (uma): Mg=24; O=16; H=1; P=31
A) VFF
B) VVF
C) FVF
D) VFV
E) FFV
Rpta. : "A"
PREGUNTA 15 :
El dióxido de nitrógeno, NO2, es de color marrón. Se forma como subproducto en los procesos de combustión a temperatura alta como en los vehículos motorizados a 187°C y una presión de 1248 torr. ¿Cuál es la densidad del gas marrón?
masa atómica (uma): N=14; O=16
A) 1,2 g/L
B) 1,5 g/L
C) 2,0 g/L
D) 2,5 g/L
E) 3,09 g/L
Rpta. : "C"
PREGUNTA 16 :
Indique la proposición incorrecta con relación a las propiedades de los gases.
A) Los gases ocupan todo el volumen del recipiente que los contiene.
B) La propiedad de expansión permite a los gases ocupar un mayor volumen.
C) El volumen y la forma de los gases son variables.
D) El orden de densidad es gases > líquidos > sólidos.
E) Pueden ser monoatómicas. Cálculos en química y Estado gaseoso
Rpta. : "D"
PREGUNTA 17 :
Un recipiente herméticamente cerrado contiene una mezcla de masas iguales de los gases NO2 y N2O4. Si la presión parcial del NO2 es 4 atm, calcule la presión parcial del N2O4.
Masa molar (g/mol): N=14; O=16
A) 2 atm
B) 4 atm
C) 6 atm
D) 8 atm
E) 5 atm
Rpta. : "A"
PREGUNTA 18 :
El metano, CH4, es un gas liviano altamente inflamable, se utiliza como combustible. Se almacena en un depósito de acero de 20m³ a 27°C y 9 atm. Por seguridad se enfría hasta – 23°C manteniéndose en fase gaseosa. ¿Cuál es la presión absoluta en esta nueva condición?
A) 4,5 atm
B) 5,5 atm
C) 6,5 atm
D) 7,5 atm
E) 8,0 atm
Rpta. : "D"
PREGUNTA 19 :
Al igualar la siguiente reacción por el método del cambio de estado de oxidación, indique verdadero (V) o falso (F) en cada proposición y marque la alternativa correspondiente.
Sn(s)+HNO3(ac)→ SnO2(s)+NO(g)+H2O(ℓ)
I) El coeficiente de la forma reducida es 3.
II) El coeficiente del agente oxidante es 4.
III) Se transfieren 12 electrones.
A) VVV
B) FVV
C) FVF
D) VVF
E) FFF
Rpta. : "B"
PREGUNTA 20 :
Respecto a las siguientes reacciones, marque la alternativa que contenga las proposiciones incorrectas.
Fe(s)+AgNO3(ac) → Ag(s)+Fe(NO3)2(ac)
Na2CO3(ac) + CaI2(ac)→ CaCO3(s)+NaI(ac)
NH4NO3(s)→ N2O(g) +H2O(g)
I) La primera reacción corresponde a desplazamiento simple.
II) La segunda reacción corresponde a doble desplazamiento.
III) La tercera reacción es de adición.
A) I y III
B) II y III
C) I y II
D) solo III
E) solo II
Rpta. : "D"
PREGUNTA 21 :
La criolita es, con la bauxita, el mineral de mayor importancia en la fabricación de aluminio, siendo su principal papel el de fundente de la alúmina en los baños electrolíticos. Actualmente se está sustituyendo la criolita por ciolita, un fluoruro artificial de aluminio, sodio y calcio. Un mineral de 500 kg contiene 5,1% en masa de óxido de aluminio (Aℓ2O3).
¿Qué masa de aluminio se obtiene del mineral con un rendimiento del 60%?
Masa molar(g/mol): Aℓ=27, O=16
A) 8,1 kg
B) 13,5 kg
C) 10,2 kg
D) 5,4 kg
E) 7,4 kg
Rpta. : "A"
PREGUNTA 22 :
Por lo general, para eliminar las incrustaciones de carbonato de calcio, CaCO3 (escoria), de las tuberías de agua, se usa ácido clorhídrico concentrado. Teóricamente, ¿cuántos kg de CaCO3 serán removidos de una tubería sí se emplea 5 litros de una solución de HCl 11,0 M?
CaCO3(s) +HCℓ(ac) → CaCℓ2(ac) +H2O(ℓ) + CO2(g)
Peso atómico: H=1; C=12, O=16, Ca=40
A) 11,1
B) 5,50
C) 1,38
D) 2,75
E) 4,75
Rpta. : "D"
PREGUNTA 23 :
El bromato de potasio, KBrO3 es una sal que durante años se ha utilizado como mejorador del pan y que actualmente está prohibida su uso en la elaboración del pan porque se considera nociva para el ser humano, produciendo principalmente daños gastrointestinales. Si se descompone térmicamente 800 g de una muestra de bromato de potasio según la reacción:
KBrO3(s)+ calor → KBr(s)+O2(g)
Determine el porcentaje de pureza de la muestra, si se obtuvo 134,4 L de gas oxígeno en condiciones normales.
Masa molar: KBrO3= 167 g/mol
A) 80,2%
B) 83,5%
C) 79,4%
D) 78,5%
E) 88,5%
Rpta. : "B"
PREGUNTA 24 :
A 20°C, se preparan diferentes cantidades de soluciones saturadas NaCℓ(ac) sabiendo que la solubilidad es 36. Determinar la masa de la solución saturada preparada utilizando 180 g de cristal NaCℓ(s).
A) 500 g
B) 580 g
C) 680 g
D) 360 g
E) 480 g
Rpta. : "C"
PREGUNTA 25 :
Con relación a las soluciones, indique las proposiciones incorrectas.
I) El solvente determina el nombre de la solución.
II) El soluto determina el estado físico de la solución.
III) La concentración de la solución depende de la cantidad de soluto.
IV) NaOH(ac) es solución electrolítica.
A) solo I
B) II y III
C) II y IV
D) I y II
E) solo III
Rpta. : "D"
PREGUNTA 26 :
Los hidróxidos de metales alcalinos térreos son sólidos cristalinos poco solubles en agua. Experimentalmente se determina que la solubilidad del Ca(OH)2 es 0,185 g/100 mL de agua. Cuál es la concentración molal.
Ca(OH)2: PF=74 uma
A) 0,020 m
B) 0,250 m
C) 0,015 m
D) 0,025 m
E) 0,185 m
Rpta. : "D"
PREGUNTA 27 :
En una fiola de 400 mL de capacidad se almacena 16 mL de peróxido de hidrógeno H2O2(ℓ), en seguida se completa la capacidad de la fiola con agua destilada. ¿Cuál es la concentración en porcentaje en volumen? Sabiendo a esta concentración la solución es utilizada como desinfectante.
A) 4%
B) 3%
C) 8%
D) 5%
E) 6%
Rpta. : "A"
PREGUNTA 28 :
¿Cuántos mililitros de solución de AgNO3(ac) 0,2M se requiere para producir 57,4g AgCℓ? La ecuación química del proceso es
AgNO3(ac) +NaCℓ(ac) → AgCℓls) +NaNO3(ac)
Masas atómicas (uma): Ag=108; Cℓ=35,5
A) 1 L
B) 3 L
C) 4 L
D) 2 L
E) 1,5 L
Rpta. : "D"
PREGUNTA 29 :
En laboratorio de química se cuenta con ácidos concentrados, tal como H2SO4(ac) 8M, sin embargo para un ensayo se necesita 80mL de H2SO4(ac) 5N, ¿cuantos mL de agua destilada se tuvo que utilizar para diluir?
A) 55
B) 25
C) 50
D) 30
E) 40
Rpta. : "A"
PREGUNTA 30 :
La ocurrencia de una reacción química compleja es explicada mediante un conjunto de pasos elementales denominado mecanismo de la reacción. Considerando el siguiente mecanismo, marque la secuencia correcta después de determinar si la proposición es verdadera (V) o falsa (F).
Etapa 1: H2+NO → H2O+ N (lenta)
Etapa 2: NO + N → N2+ O (rápida)
Etapa 3: H2+O → H2O (rápida)
I) La reacción química global es:
2H2+2NO → N2+2H2O
II) Al duplicar la concentración del H2, la velocidad de la reacción se cuadruplica.
III) La ecuación de velocidad es v=k[H2][NO].
A) FVF
B) VVV
C) FVV
D) VFF
E) VFV
Rpta. : "E"
PREGUNTA 31 :
Las reacciones químicas pueden ocurrir en un forma rápida o lenta así se puede observar que el hierro se corroe lentamente mientras que la quema de los pirotécnicos explota violentamente. Señale la alternativa que contiene los factores que, al incrementarse, aumentan la velocidad de una reacción química.
A) Volumen - inhibidor - catalizador
B) Tensión superficial - presión - área de contacto
C) Temperatura - superficie de contacto - concentración
D) Viscosidad - tensión superficial - catalizador
E) Área superficial - volumen - color
Rpta. : "C"
PREGUNTA 32 :
En la siguiente reacción química en equilibrio a 327 °C.
CO(g) + Cℓ2(g) → COCℓ2(g)
Experimentalmente se muestra que hay 0,5 moles de COCl2(g), 0,1 moles de CO(g) y 0,25 moles de Cℓ2(g) en un recipiente de 10 litros, calcule la constante de equilibrio Kp.
A) 100
B) 200
C) 250
D) 150
E) 280
Rpta. : "B"
PREGUNTA 33 :
Respecto a las características generales del equilibrio químico, indique la alternativa correcta.
A) Se da en una reacción reversible en un tiempo finito
B) A nivel macroscópico la presión, la temperatura y la concentración no permanece constante
C) En el equilibrio la velocidad directa e inversa son diferentes
D) La concentración de productos y reactantes son iguales.
E) Se da en cualquier tipo de reacción química.
Rpta. : "A"
PREGUNTA 34 :
Respecto al siguiente sistema en equilibrio a 250°C
H2O(g) +C(s)+ Calor ⇄ CO(g) +H2(g) Indique la alternativa correcta.
A) Si aumentamos el volumen del reactor disminuye el rendimiento
B) Si la temperatura se duplica, el valor de Kc disminuye
C) Si se aumenta carbono pulverizado la reacción se desplaza temporalmente a la derecha
D) Si aumenta la presión del sistema en equilibrio disminuye el rendimiento
E) Si agrega un catalizador, el valor de Kc aumenta
Rpta. : "D"
PREGUNTA 35 :
La composición molar en el sistema en equilibrio en la síntesis del amoniaco es, 50% de NH3(g), 25% de N2(g) y el resto hidrogeno si la presión total del sistema en equilibrio es 80 atm, determine la constante de equilibrio en función de las presiones parciales Kp.
3H2(g) +N2(g)→ 2NH3(g)
A) 100
B) 0,01
C) 0,10
D) 10,0
E) 0,20
Rpta. : "B"
PREGUNTA 36 :
Se preparan soluciones acuosas electrolíticas, indicar aquellos solutos que incrementaron la concentración del protón del agua a condiciones ambientales.
A) H2S y CaCℓ2
B) NH3 y HNO3
C) HI y H2SO4
D) CH3OH y HCℓ
E) NaCl y HCℓ
Rpta. : "C"
PREGUNTA 37 :
A la misma temperatura, en un vaso precipitado se juntan 50 mL de potasa cáustica KOH(ac) 4,8 M y 150 mL de H2SO4(ac) 1,8 N, luego de agitar indicar lo que se cumple
A) la temperatura no cambia
B) la mezcla final es neutra
C) la mezcla final básica
D) la mezcla final es ácida
E) la temperatura disminuye
Rpta. : "D"
PREGUNTA 38 :
Las reacciones químicas pueden ser del tipo oxido-reducción tal como la electrólisis de sustancias químicas y soluciones acuosas, al respecto indicar las proposiciones correctas.
I) Es un proceso químico no espontáneo.
II) Una sustancia se descompone por acción de la corriente eléctrica alterna.
III) La electrólisis de NaCℓ(ℓ) genera sodio (Na) y cloro(Cℓ).
A) II y III
B) I y III
C) I y II
D) solo III
E) solo I
Rpta. : "E"
PREGUNTA 39 :
El agua conduce muy débilmente la electricidad, si se mezcla con una pequeña cantidad de H2SO4 se hace más conductora. Si a esta condición la temperatura es 25°C y la molaridad 0,05 M determinar el pH y pOH.
A) 1 y 13
B) 1,3 y 12,7
C) 1,7 y 12,3
D) 2 y 12
E) 3 y 11
Rpta. : "A"
PREGUNTA 40 :
Indique la masa en gramos de producto obtenido en el cátodo y ánodo respectivamente durante la electrólisis de CuCℓ2(ac), concentrada al circular una cantidad de carga eléctrica equivalente a 10 Faraday.
PA (uma): Cu= 63,5; Cℓ=35,5; H=1; O=16
A) 10 g de H2 y 80 g de O2
B) 317,50 g de Cu y 355 g de Cℓ2
C) 10 g de H2 y 355 g de Cℓ2
D) 635 g de Cu y 710 g de Cℓ2
E) 317,50 g de Cu y 80 g de O2
Rpta. : "B"
PREGUNTA 41 :
En una sesión de laboratorio de electroquímica se muestra a cinco celdas electrolíticas conectadas en serie, donde ocurre la electrólisis simultánea de las soluciones concentradas, indique aquella donde solo el soluto se descompone.
A) AgNO3(ac)
B) KI(ac)
C) KNO3(ac)
D) ZnSO4(ac)
E) CuCℓ2(ac)
Rpta. : "E"
PREGUNTA 42 :
En la combustión completa de 5,80 g de un alcano o parafina, se produce 0,4 mol de CO2. ¿Qué volumen de gas oxígeno en litros se consumirá en condiciones normales?
Masa atómica (uma): C=12; H=1
A) 44,8
B) 14,56
C) 11,2
D) 67,2
E) 18,56
Rpta. : "B"
PREGUNTA 43 :
La formulación de los acondicionadores capilares incluye sustancias como las iminas que, al eliminar la carga estática, facilitan el peinado y mejoran la suavidad del cabello. Determine el número de átomos de carbono que tienen hibridación sp, sp2 y sp3, respectivamente, en la molécula de CH3CH=NCH3.
A) 1 ,0 y 2
B) 1, 2 y 3
C) 0, 1 y 2
D) 0, 2 y 1
E) 2, 0 y 1
Rpta. : "C"
PREGUNTA 44 :
Los compuestos aromáticos son aquellos que poseen las propiedades especiales asociadas con el núcleo o anillo del benceno. Con respecto al benceno señale lo correcto.
I) Sus moléculas de naturaleza apolar presentan enlaces sigma deslocalizados.
II) Para su combustión completa se requiere 8,5 moles de O2 por cada mol de benceno.
III) Sus átomos de carbono poseen hibridación sp2.
A) Solo I
B) Solo II
C) I y III
D) Solo III
E) II y III
Rpta. : "D"
PREGUNTA 45 :
Determine la masa molar (g/mol) de un compuesto orgánico cuyo nombre es
7-etil-3,4-dimetilnona-1-en-5-ino.
Masa atómica (uma): C=12; H=1
A) 178
B) 176
C) 180
D) 166
E) 188
Rpta. : "A"
PREGUNTA 46 :
Actualmente se vienen tomando medidas para eliminar o atenuar la presencia de contaminantes en el agua, que afectan el ecosistema. indique aquella medida que no corresponde o no se cumple.
A) Depurar las aguas residuales.
B) Control el uso excesivo de pesticidas y otros tipos de productos químicos en la agricultura.
C) No utilizar agua contaminada para el regadío de cultivos.
D) Eliminar el uso de plásticos de un solo uso
E) Vertimiento de aguas residuales industriales sin autorización.
Rpta. : "E"
PREGUNTA 47 :
El ozono O3, es un gas azulino irritante que rodea al planeta tierra formando una capa que absorbe parte de los rayos ultravioletas, protegiendo a los seres vivos de los efectos negativos de estos rayos solares. Al respecto indicar las proposiciones incorrectas.
I) La capa de ozono, absorbe a toda la radiación ultra violeta A.
II) El NO2, es un contaminante químico que afecta a la capa de ozono.
III) El adelgazamiento de la capa de ozono no afecta a la fauna marina.
A) solo I
B) solo II
C) I y II
D) I y III
E) II y III
Rpta. : "D"
PREGUNTA 48 :
De acuerdo a la siguiente reacción química, indique la secuencia correcta de verdad (V) o falsedad (F).
CH3OH+CH3COOH ⇄ P +H2O
I) El producto (P) pertenece a la función éster.
II) La fórmula del compuesto (P) es CH3COOCH3.
III) El nombre del compuesto (P) es metanoato de etilo.
A) VVV
B) FVF
C) VFF
D) VVF
E) VFV
Rpta. : "D"
SEGUNDA PRACTICA
PREGUNTA 1 :
Durante un ensayo de laboratorio de fisicoquímica se desea determinar la densidad de una esfera de plomo. Para ello se sumerge una esfera de dicho metal cuya masa es de 57 g en una probeta graduada que contiene un volumen inicial de agua de 15,00 mL alcanzándose un volumen final de 20,00 mL. Al respecto, determine la densidad del plomo en unidades del SI.
A) 1,14×103
B) 1,14×104
C) 1,14×102
D) 1,14×105
E) 1,14×101
Rpta. : "B"
PREGUNTA 2 :
La mezcla que se clasifica como heterogénea es de constitución física no uniforme como por ejemplo el agua con aceite, y si se clasifica como homogénea es cuando su aspecto físico es uniforme; por ejemplo, una solución de suero salino. Respecto al enunciado, seleccione la alternativa que contenga los métodos con los cuales se pueden separar los componentes de las mezclas respectivamente.
A) Destilación – filtración
D) Decantación – evaporación
B) Decantación – filtración
E) Filtración – destilación
C) Filtración – evaporación
Rpta. : "D"
PREGUNTA 3 :
El gas natural vehicular (GNV) es una mezcla de hidrocarburos cuyo componente principal es el metano; esta mezcla posee una densidad de 0,737 kg/m³ a 15ºC, es un combustible más amigable y para ser utilizado es necesario colocarlo en cilindros de 323 mm de diámetro, con una capacidad de 20 L y una masa de 58 kg, siendo su máxima presión de operación de 20 MPa. Con respecto a las magnitudes mencionadas, seleccione la alternativa que contiene respectivamente el número de magnitudes básicas y derivadas.
A) 3 y 1
B) 4 y 2
C) 3 y 3
D) 1 y 5
E) 6 y 0
Rpta. : "C"
PREGUNTA 4 :
Los fenómenos físicos son cambios en donde la materia no pierde su identidad, es decir, su composición química no se altera; mientras que en un fenómeno químico la composición química sí se altera. Identifique como fenómeno físico (F) o químico (Q) según corresponda a los siguientes cambios:
I) Condensación de la lluvia
II) Volatilización de la acetona
III) Fermentación de frutas
IV) Solubilidad del azúcar
V) Oxidación de los metales
A) FQQFQ
B) FFQFQ
C) QQQFQ
D) QFFFQ
E) FQFQQ
Rpta. : "B"
PREGUNTA 5 :
Las pirámides de Egipto son consideradas una de las maravillas de la humanidad. Las dimensiones de la pirámide de Keops son las siguientes: 138 metros de altura, un volumen de 2,59×106 m³ y un área total de 53055 m². Está formada por un techo de granito cuya densidad aproximada es 2,69 g/cm³ y una masa de 400 toneladas. Dichas pirámides se encuentran ubicadas en la meseta de Guiza donde la temperatura promedio anual es 27°C. Al respecto, determine el número de magnitudes básicas y derivadas mencionadas en el texto respectivamente.
A) 4 y 2
B) 5 y 1
C) 1 y 5
D) 6 y 0
E) 3 y 3
Rpta. : "E"
PREGUNTA 6 :
La separación de mezclas o separación de fases es un proceso físico mediante el cual se pueden separar los componentes de una mezcla. Al respecto, seleccione la relación correcta método de separación – mezcla.
I) Destilación
II) Imantación
III) Tamizado
IV) Decantación
( ) Agua con piedras
( ) tierra y hierro
( ) arena con piedras
( ) Agua con acetona
A) III, II, IV, I
B) IV, II, III, I
C) I, II, III, IV
D) IV, III, II, I
E) IV, II, I, III
Rpta. : "B"
PREGUNTA 7 :
La mayor parte de las necesidades energéticas actuales se cubren mediante los llamados combustibles fósiles. Al quemar cierto tipo de carbón, se liberó 8,36×106 J de energía incrementándose la temperatura en 20ºC. Determine la capacidad calorífica en cal/ºC de esta materia carbonífera.
Dato: 1 cal=4,18J
A) 1,0×105
B) 4,1×106
C) 1,2×106
D) 2,0×105
E) 2,4×104
Rpta. : "A"
PREGUNTA 8 :
El dióxido de azufre (SO2) es un gas que presenta un olor picante, es soluble en agua (11,3 g/100g de agua a 20ºC), en presencia de oxígeno molecular forma trióxido de azufre. Ataca fácilmente a los metales y su punto de ebullición es de –10°C a nivel del mar. Al respecto, determine respectivamente, el número de propiedades químicas y físicas del compuesto.
A) 2 y 4
B) 3 y 2
C) 4 y 3
D) 1 y 4
E) 1 y 3
Rpta. : "A"
PREGUNTA 9 :
El metanol es un líquido incoloro, soluble en agua, presenta a 25°C una densidad de 0,81 g/mL y un calor específico de 1,37 J/g.K. Además, tiene una temperatura de ebullición de 64,7°C a 1 atm. Al respecto, determine el número de magnitudes básicas y derivadas mencionadas en el texto respectivamente.
A) 1 y 3
B) 2 y 2
C) 3 y 1
D) 4 y 0
E) 0 y 4
Rpta. : "A"
PREGUNTA 10 :
Una barra de cobre de 4 metros de largo, presenta un color cobrizo, con 150 m³ de volumen, tiene una densidad de 8,96×10³ kg/m³, una conductividad térmica de 400 W/(K.m), presenta un calor específico de 385 J/kg.K. Al respecto, determine el número de propiedades intensivas mencionadas en el texto.
A) 3
B) 2
C) 5
D) 4
E) 1
Rpta. : "D"
PREGUNTA 11 :
Una fábrica de aditivos alimentarios produce ésteres sintéticos, los cuales son sustancias responsables de los olores o fragancias artificiales, por ejemplo: el etanoato de isopentilo (olor a plátano) o etanoato de butilo (olor a manzana). Para sintetizar los esteres se requiere hidruros de bario y estaño, los cuales son empleados como agentes reductores químicos. Indique el nombre sistemático del BaH2 y el nombre Stock de SnH2, respectivamente.
A) Dihidruro de bario e hidruro de estaño (II)
B ) DiHidruro de bario e dihidruro de estaño
C) Hidruro bárico e hidruro de estaño (II)
D) Dihidruro de bario e hidruro estánnico
E) Hidruro de bario (II) e hidruro de estaño (II)
Rpta. : "A"
PREGUNTA 12 :
El sodio es una sustancia que se clasifica como elemento químico, es de color plateado, que se vuelve gris al exponerse al aire, y arde violentamente con el agua. Presenta una densidad de 0,968 g/ml, su punto de fusión es 97,81 °C, su capacidad calorífica es de 0,292 cal/g y su calor específico de 2,01 kJ/kg.K. Al respecto, seleccione el valor de verdad (V o F) para cada proposición.
I) La temperatura y la densidad son magnitudes derivadas.
II) La exposición del metal al aire implica un cambio químico.
III) Se mencionan seis propiedades físicas y una propiedad química.
A) FVF
B) VVF
C) FVV
D) VFV
E) VFF
Rpta. : "A"
PREGUNTA 13 :
La longitud de enlace se define como la distancia que hay entre los núcleos de dos átomos unidos entre sí. Por ejemplo, la longitud del enlace carbono – oxígeno (C – O) es de 0,14 nm y del enlace oxígeno – hidrógeno (O – H) es de 0,1 nm. Al respecto, determine la diferencia de ambas longitudes en femtómetros (fm).
A) 4,0×104
B) 3,0×105
C) 4,0×10–4
D) 4,0×10–5
E) 3,0×10–5
Rpta. : "A"
PREGUNTA 14 :
Einstein propuso la ecuación más famosa de la historia: la energía es igual a la masa por la velocidad de la luz al cuadrado (E=mc²). Fue una deducción que enseguida permitió entender fenómenos inexplicados hasta el momento, cómo, por qué y cuándo el uranio radioactivo se desintegraba, su peso disminuía y generaba una enorme cantidad de energía. Si se desintegra 10 nanogramos de material radiactivo, determine la energía en Joule que se liberó durante este proceso nuclear.
Dato: J = kg×m²/s² ; c = 3×108 m/s
A) 9,0×105
B) 9,0×103
C) 4,5×104
D) 4,5×105
E) 9,0×102
Rpta. : "A"
PREGUNTA 15 :
El fósforo–32 (32P) tiene un número atómico de 15. Los radiofármacos de 32P se aplican en el tratamiento de dolor óseo metastásico. Con respecto al átomo neutro de fósforo, seleccione el valor de verdad (V o F) para cada proposición.
l. En su núcleo, presenta 15 protones, 17 neutrones y 15 electrones.
II. Tiene menor cantidad de electrones que el 16S2– .
III. Al ganar 3 electrones, forma un catión trivalente.
A) FVV
B) VVF
C) VFV
D) FFV
E) FVF
Rpta. : "E"
PREGUNTA 16 :
La química es una ciencia natural que estudia a la materia con la finalidad de obtener productos que mejoren la calidad de vida del ser humano. Para un mejor estudio la química está dividida en diferentes. Al respecto, determine la relación correcta entre rama de la química – tema de investigación.
a) Química analítica
b) Química inorgánica
c) Fisicoquímica
d) Bioquímica
( ) Determinación de la velocidad de reacción
( ) Concentración de mercurio en agua
( ) Efectos secundarios de la morfina.
( ) Obtención de bronce a partir del cobre.
A) abcd
B) cadb
C) cabd
D) abdc
E) bacd
Rpta. : "B"
PREGUNTA 17 :
El lactisole (C10H11O4Na) es un compuesto muy utilizado en la industria alimentaria como un inhibidor del dulzor o como modificador de sabor; un precursor de este compuesto se puede aislar de los granos tostados de café arábigo colombiano. Con respecto a los átomos que forman el compuesto, seleccione la alternativa correcta.
Datos:1H;6C;8O;11Na
A) El carbono posee mayor electronegatividad que el oxígeno.
B) El sodio posee la mayor energía de ionización.
C) El oxígeno es el elemento de mayor tamaño.
D) El hidrógeno es un metal alcalino de la familia IA.
E) El sodio posee mayor carácter metálico que el carbono.
Rpta. : "E"
PREGUNTA 18 :
Los balones de fútbol tienen diversas dimensiones según su utilidad. Los que se emplean en el fútbol profesional presentan las siguientes dimensiones aprobadas por la FIFA: su volumen es 5500 cm³ y la presión máxima del aire en su interior es 15,6 PSI. Exprese el volumen y la presión en unidades del SI, del aire en el interior de dicho balón de fútbol.
(Datos: 1 atm = 14,7 PSI =1,0×105 Pa)
A) 5,50×10–2 – 1,06×105
B) 5,50×10–3 – 1,06×105
C) 5,50×10–2 – 1,06×103
D) 5,50×10–3 – 1,06×103
E) 5,50×10–3 – 1,06×102
Rpta. : "B"
PREGUNTA 19 :
Los gases invernadero son aquellos que están en la atmósfera y pueden absorber radiación infrarroja (IR); su acumulación hace que este efecto aumente y se genere el calentamiento global. Alguno de estos gases son H2O , CO2, SF6, CH4.
Al respecto, seleccione la alternativa que contiene las moléculas que cumplen con la regla del octeto.
Datos:1H;6C;8O;16S;9F
l. H2O
II. CO2
III. SF6
IV. CH4
A) Solo III
B) I, III y IV
C) Solo I y III
D) Solo II
E) Solo I y II
Rpta. : "D"
PREGUNTA 20 :
Durante un ensayo en el laboratorio de análisis, se coloca en una probeta 20 mL de agua, luego se añade una esfera de cobre (Cu) aumentando el volumen de agua hasta 25 mL. Al respecto, determine la masa de la esfera de cobre, en unidades del SI.
(Dato: 𝜌Cu=8,96 𝑔/𝑐𝑚³)
A) 4,48×10–1
B) 4,48×102
C) 4,48×10–2
D) 4,48×101
E) 4,48×103
Rpta. : "C"
PREGUNTA 21 :
El 16 de julio de 1945, se realizó «La prueba Trinity» para ejecutar el arma nuclear desarrollado por los aliados durante la Segunda Guerra Mundial. La energía liberada fue en promedio igual a 90 terajoule (TJ), la bomba detonada usaba como material fisionable al plutonio, el mismo tipo que sería lanzado en Nagasaki. Determine el rendimiento del proceso si se esperaba la total reacción nuclear de 4,0×103 miligramos de plutonio.
Dato: c = 3,0×108 (m/s) ; 1 TJ = 1012 J
A) 35
B) 50
C) 75
D) 25
E) 60
Rpta. : "D"